- + Merck Millipore
- + Thermo Fisher
- + IKA
- + 顯微鏡
- + 光度計(jì)
- + 成像系統(tǒng)
- + MACS Miltenyi
- + 均質(zhì)機(jī)
- + 粒子計(jì)數(shù)器
- + 凍干機(jī)
- + 滅菌系統(tǒng)
- + 細(xì)胞
- + 微量移液工作站
- + 振蕩培養(yǎng)箱
- + 生物反應(yīng)器
- + 切片機(jī)
- + 培養(yǎng)箱
- + 蠕動(dòng)泵
- + 細(xì)胞破(粉)碎機(jī)
- + 轉(zhuǎn)印膜
- + 超濾管
- + Pellicon 超濾系統(tǒng)
- + 超低溫冰箱
- + 清洗機(jī)
- + 干燥機(jī)
- + 洗瓶機(jī)
- + 離心泵
- + 容積泵
- + 各種閥
- + 酶標(biāo)儀
- + 洗衣板
- + 旋光儀
- + 折光儀
- + 行星球磨機(jī)
- + 振動(dòng)篩
- + 基因?qū)雰x
- + 手套系列
- + 接頭\\連接器
- + 培養(yǎng)板/培養(yǎng)瓶
- + 溫度控制系統(tǒng)
- + 制冷器
- + 存取系統(tǒng)
- + 軋蓋機(jī)
- + 細(xì)胞因子
- + 細(xì)胞分選儀
- + 生物安全柜
- + 滲透壓儀
- + 拉曼光譜儀
- + 電泳系統(tǒng)
- + 純水系統(tǒng)
- + 萃取儀
- + 譜新生物
- + TA 儀器
- + wako
- + 沃特世(Waters)
第一期 || 淺談IVD行業(yè)公用系統(tǒng)監(jiān)測(cè)和微生物檢測(cè)法規(guī)
更新時(shí)間:2019-12-03 瀏覽次數(shù):3000
國(guó)慶長(zhǎng)假已經(jīng)結(jié)束~祝賀大家喜提2019年所有法定節(jié)假日,接下來(lái)又該投入忙碌的科研工作生活了!
小編在假期前的推文中留了一個(gè)“小尾巴”——“基于樣品檢測(cè)量多少的變更需要進(jìn)行適用性檢查嗎?”
(點(diǎn)擊回顧→ “國(guó)慶堵”vs“濾膜堵”)
對(duì)于這個(gè)問題,我們的建議是:由于原來(lái)10ml的供試液較1ml的藥濃更高,如含抑菌成份則抑菌性更強(qiáng),所以在方法適用性檢查上能包括濃度更低的供試液,所以建議只需走公司內(nèi)部規(guī)定的變更-修改SOP和記錄流程即可,不需要重新進(jìn)行驗(yàn)證。
解決完“遺留問題”,接下來(lái)本文將以法規(guī)要求作為指導(dǎo)幫助大家梳理IVD行業(yè)中關(guān)于微生物監(jiān)測(cè)的方法。
醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范(GMP)在2015年10月份生效,其中有三大附錄:《無(wú)菌醫(yī)療器械》、《植入性醫(yī)療器械》、《體外診斷試劑》。
下面我將整體分析IVD行業(yè)關(guān)于公用系統(tǒng)和檢測(cè)樣品方面的微生物控制。
?《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范附錄體外診斷試劑》
2.2.3應(yīng)當(dāng)根據(jù)體外診斷試劑的生產(chǎn)過(guò)程控制,確定在相應(yīng)級(jí)別的潔凈室(區(qū))內(nèi)進(jìn)行生產(chǎn)的過(guò)程,避免生產(chǎn)中的污染。空氣潔凈級(jí)別不同的潔凈室(區(qū))之間的靜壓差應(yīng)當(dāng)大于5帕,潔凈室(區(qū))與室外大氣的靜壓差應(yīng)大于10帕,并應(yīng)當(dāng)有指示壓差的裝置。相同級(jí)別潔凈室間的壓差梯度應(yīng)當(dāng)合理。
2.2.5陰性或陽(yáng)性血清、質(zhì)粒或血液制品等的處理操作,生產(chǎn)區(qū)域應(yīng)當(dāng)不低于10000級(jí)潔凈度級(jí)別,并應(yīng)當(dāng)與相鄰區(qū)域保持相對(duì)負(fù)壓。
2.2.11潔凈室(區(qū))的溫度和相對(duì)濕度應(yīng)當(dāng)與產(chǎn)品生產(chǎn)工藝要求相適應(yīng)。無(wú)特殊要求時(shí),溫度應(yīng)當(dāng)控制在18~28℃,相對(duì)濕度控制在45%~65%。
2.2.19進(jìn)行危險(xiǎn)度二級(jí)及以上的病原體操作應(yīng)當(dāng)配備生物安全柜,空氣應(yīng)當(dāng)進(jìn)行過(guò)濾處理后方可排出。應(yīng)當(dāng)對(duì)過(guò)濾器的性能進(jìn)行定期檢查以保證其有效性。使用病原體類檢測(cè)試劑的陽(yáng)性血清應(yīng)當(dāng)有相應(yīng)的防護(hù)措施。
2.2.20對(duì)于特殊的高致病性病原體的采集、制備,應(yīng)當(dāng)按照有關(guān)部門頒布的行業(yè)標(biāo)準(zhǔn),如人間傳染病微生物名錄、微生物和生物醫(yī)學(xué)實(shí)驗(yàn)室生物安全通用準(zhǔn)則、實(shí)驗(yàn)室生物安全通用要求等相關(guān)規(guī)定,配備相應(yīng)的生物安全設(shè)施。
2.3.1潔凈室(區(qū))空氣凈化系統(tǒng)應(yīng)當(dāng)經(jīng)過(guò)確認(rèn)并保持連續(xù)運(yùn)行,維持相應(yīng)的潔凈度級(jí)別,并在一定周期后進(jìn)行再確認(rèn)。若停機(jī)后再次開啟空氣凈化系統(tǒng),應(yīng)當(dāng)進(jìn)行必要的測(cè)試或驗(yàn)證,以確認(rèn)仍能達(dá)到規(guī)定的潔凈度級(jí)別要求。
2.6.9應(yīng)當(dāng)制定潔凈室(區(qū))的衛(wèi)生管理文件,按照規(guī)定對(duì)潔凈室(區(qū))進(jìn)行清潔處理和消毒,并做好記錄。所用的消毒劑或消毒方法不得對(duì)設(shè)備、容器具、物料和產(chǎn)品造成污染。消毒劑品種應(yīng)當(dāng)定期更換,防止產(chǎn)生耐藥菌株。
2.7.2生產(chǎn)和檢驗(yàn)用的菌毒種應(yīng)當(dāng)標(biāo)明來(lái)源,驗(yàn)收、儲(chǔ)存、保管、使用、銷毀應(yīng)執(zhí)行國(guó)家有關(guān)醫(yī)學(xué)微生物菌種保管的規(guī)定和病原微生物實(shí)驗(yàn)室生物安全管理?xiàng)l例。應(yīng)當(dāng)建立生產(chǎn)用菌毒種的原始種子批、主代種子批和工作種子批系統(tǒng)。
以下為內(nèi)容大綱,本文將從三個(gè)方面進(jìn)行分析梳理,今天先從“潔凈度監(jiān)測(cè)”方面展開。
?1、潔凈度監(jiān)測(cè)
2、溫濕度和壓差監(jiān)測(cè)
3、病原微生物實(shí)驗(yàn)室
一、潔凈度監(jiān)測(cè)
? 相關(guān)法規(guī)
《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》
《GB 50591-2010 潔凈室施工及驗(yàn)收規(guī)范》
《GBT 16292-2010 醫(yī)藥工業(yè)潔凈室(區(qū))懸浮粒子的測(cè)試方法》
《GBT 16293-2010 醫(yī)藥工業(yè)潔凈室(區(qū))浮游菌的測(cè)試方法》
《GBT 16294-2010 醫(yī)藥工業(yè)潔凈室(區(qū))沉降菌的測(cè)試方法》
《ISO 14644-1:2015 潔凈室和相關(guān)受控環(huán)境 第一部分:根據(jù)粒子濃度劃分空氣潔凈度等級(jí)》
《2010年藥品GMP指南:無(wú)菌藥品》
? 粒子監(jiān)測(cè)
潔凈區(qū)參考《GB 50591-2010》的要求,按照《GBT 16292-2010》方法對(duì)粒子進(jìn)行監(jiān)測(cè),級(jí)別為百級(jí)、萬(wàn)級(jí)、十萬(wàn)級(jí),生產(chǎn)或檢測(cè)區(qū)域潔凈度不低于十萬(wàn)級(jí)。
根據(jù)《GBT 16292-2010》描述,該法規(guī)是參照《ISO 14644-1》,現(xiàn)新版為2015版,建議按《ISO 14644-1:2015》執(zhí)行,較《ISO 14644-1:1999》和《GBT 16292-2010》,其在取樣點(diǎn)數(shù)、采樣次數(shù)、zui小取樣量、結(jié)果判定、取樣管長(zhǎng)度、粒子計(jì)算器符合要求均有所不同。
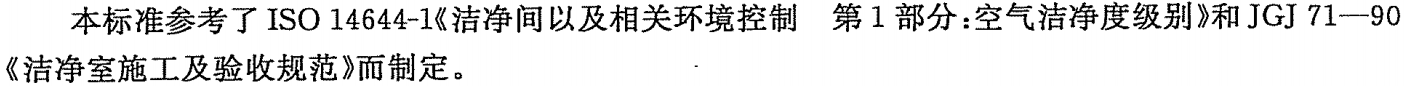
▲《GBT 16292-2010》
? 沉降菌和浮游菌監(jiān)測(cè)
培養(yǎng)基和時(shí)間參考《GBT 16294-2010》,TSA在30-35℃培養(yǎng)不小于2天,SDA在20-25℃培養(yǎng)不小于5天;但zui少采樣點(diǎn)數(shù)目不應(yīng)參考《GBT 16294-2010》,應(yīng)參考《ISO 14644-1:2015》。


▲《GBT 16294-2010》
? 標(biāo)準(zhǔn)方面
參照醫(yī)療器械GMP,以下是沉降菌動(dòng)靜態(tài)監(jiān)測(cè)0.5小時(shí)的結(jié)果,而粒子數(shù)結(jié)果判定不需要計(jì)算95%UCL;
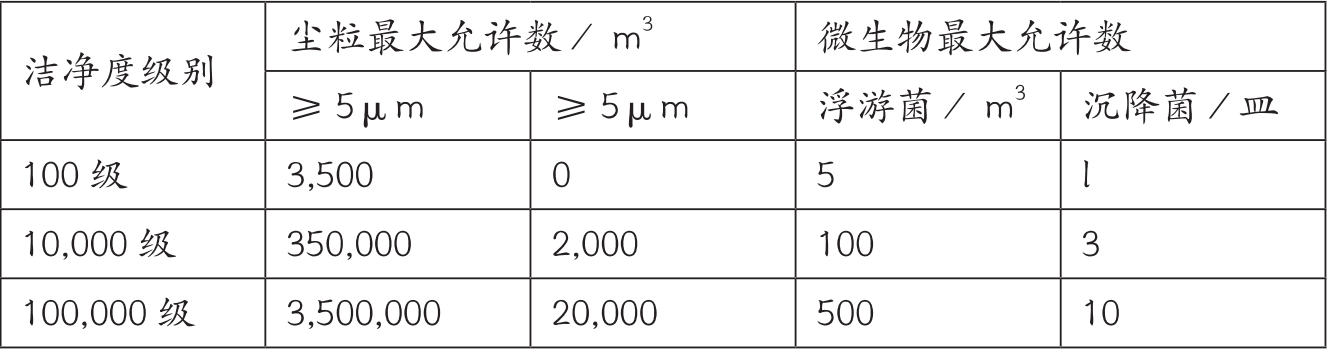
推薦使用Merck環(huán)境監(jiān)測(cè)成品培養(yǎng)基和MAS-100 NT浮游菌采樣器


? 監(jiān)測(cè)頻率
《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范附錄體外診斷試劑》
2.3.1潔凈室(區(qū))空氣凈化系統(tǒng)應(yīng)當(dāng)經(jīng)過(guò)確認(rèn)并保持連續(xù)運(yùn)行,維持相應(yīng)的潔凈度級(jí)別,并在一定周期后進(jìn)行再確認(rèn)。若停機(jī)后再次開啟空氣凈化系統(tǒng),應(yīng)當(dāng)進(jìn)行必要的測(cè)試或驗(yàn)證,以確認(rèn)仍能達(dá)到規(guī)定的潔凈度級(jí)別要求。
靜態(tài)監(jiān)測(cè)要求參考《GB 50591-2010》,動(dòng)態(tài)監(jiān)測(cè)根據(jù)用戶風(fēng)險(xiǎn)評(píng)估制定;
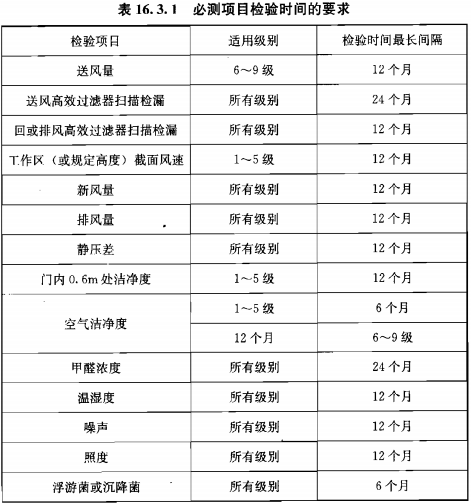
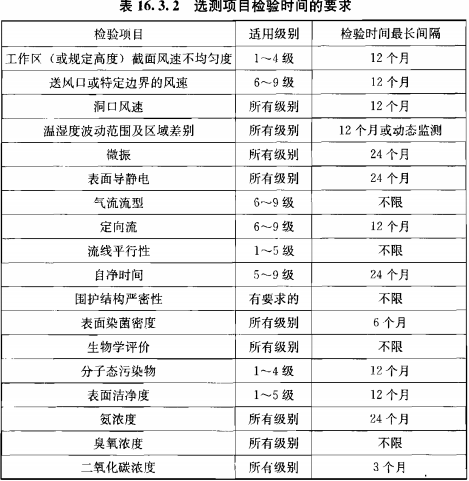
建議動(dòng)態(tài)監(jiān)測(cè)參考2010年藥品GMP指南:無(wú)菌藥品,百級(jí)每批生產(chǎn),萬(wàn)級(jí)、十萬(wàn)級(jí)每周一次;
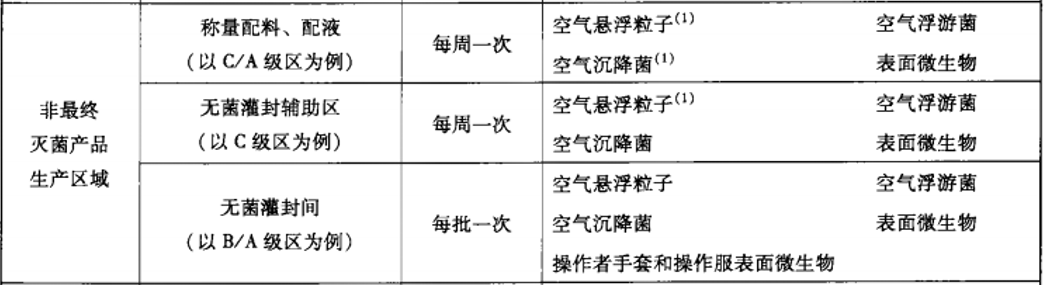
推薦使用TSI 9500系統(tǒng)便攜式粒子計(jì)數(shù)器,有28.3L、50L、100L型號(hào),用于百級(jí)、萬(wàn)級(jí)、十萬(wàn)級(jí)潔凈區(qū)的塵埃粒子監(jiān)測(cè)。內(nèi)含多種標(biāo)準(zhǔn)《ISO14644-1:1999》、《EUGMP-ISO:1999》、《ISO14644-1:2015》、《EUGMP-ISO:2015》,適合制藥行業(yè)和醫(yī)療器械行業(yè)的使用。輸入”面積”、“潔凈等級(jí)”、“選擇標(biāo)準(zhǔn)”和“房間狀態(tài)”后自動(dòng)生成“通道”、“取樣量”、“位點(diǎn)數(shù)”、“取樣時(shí)間”等的數(shù)據(jù),其數(shù)據(jù)完整性符合FDA 21 CFR PART11、Part211和212要求;

以上就是“潔凈度監(jiān)測(cè)”的分析內(nèi)容,下期將圍繞“溫濕度和壓差監(jiān)測(cè)”展開分析梳理,敬請(qǐng)期待!
- (上一篇):想除熱原?買它!!
- (下一篇):生物安全柜怎么用更安全?